- ATMPs คือ ผลิตภัณฑ์การแพทย์ขั้นสูงคือ ผลิตภัณฑ์ที่มีส่วนผสมของ ยีน เซลล์ หรือเนื้อเยื่อของสิ่งมีชีวิต มีความสำคัญอย่างไร?
- ATMPs ตัวแรกของโลก เกิดขึ้นในปี 2003 จนถึงปัจจุบันในสหรัฐฯ มีผลิตภัณฑ์ที่ขึ้นทะเบียนแล้ว 45 ตัว
- แล้วไทยจะมี ATMPs ใช้ตัวแรกเมื่อไหร่? ตามนโยบายการผลักดันของกระทรวงสาธารณสุข
ATMPs ย่อมาจาก Advanced Therapy Medical Products: ATMPs ซึ่งทางกระทรวงสาธารณสุขเรียกว่า ‘ผลิตภัณฑ์การแพทย์ขั้นสูง’ ซึ่งคำว่า ATMPs เป็นคำที่ใช้เรียกในวงการแพทย์ฝั่งยุโรป แต่หากเป็นในทางสหรัฐอเมริกาจะเรียกว่า ‘Cell and Gene Therapy Products’ หรือ ‘ผลิตภัณฑ์ยีนและเซลล์บำบัด’
ตามประกาศของ สำนักงานคณะกรรมการอาหาการและยา (อย.) ATMPs ประกอบด้วยผลิตภัณฑ์ที่มีส่วนผสมของ ยีน เซลล์ หรือเนื้อเยื่อของสิ่งมีชีวิต ที่มุ่งหมายสำหรับใช้ในการวินิจฉัย บำบัด บรรเทา รักษา หรือป้องกันโรค หรือความเจ็บป่วยของมนุษย์ หรือมุ่งหมายสำหรับให้เกิดผลแก่สุขภาพ โครงสร้างหรือกระทำหน้าที่ใดๆ ของร่างกายมนุษย์ โดยจัดเป็นยาและควบคุมภายใต้พระราชบัญญัติยา พ.ศ.2510 และที่แก้ไขเพิ่มเติม
จากการประกาศนี้เองส่งผลให้ ATMPs ถูกจัดอยู่ภายใต้ผลิตภัณฑ์ ‘ยา’ ตั้งแต่ปี พ.ศ.2566 เป็นต้นมา
ATMPs มักจะเรียกว่าเป็น ‘ยาที่มีชีวิต’ (Living Drugs) เนื่องจากกระบวนการเป็นการนำ ‘เซลล์ที่มีชีวิต’ หรือ ‘สารพันธุกรรมที่ยังทำงานได้’ นำมาดัดแปลงพันธุกรรมบางอย่างเพื่อส่งยีนกลับเข้าสู่ร่างกาย ซึ่งจะแตกต่างจากยาทั่วไป ที่จะมีโครงสร้างคงที่ ไม่เปลี่ยนแปลง แต่ ATMPs จะสามารถมีชีวิตอยู่ในร่างกายและตอบสนองต่อสิ่งแวดล้อมในร่างกายได้ไปเรื่อยๆ

ตัวอย่างเทคโนโลยีผลิต ‘ยาที่มีชีวิต’ ซึ่งปัจจุบันเป็นที่รู้จักกันดีทั่วโลกคือ คาร์ทีเซลล์ (CAR-T Cell) ซึ่งเป็นการนำ T เซลล์ของผู้ป่วยนำออกมาจากร่างกาย เพื่อนำมาสอนให้สามารถสู้รบกับ ‘มะเร็ง’ ได้ และนำกลับเข้าสู่ร่างกายเพื่อโจมตีเซลล์มะเร็งอย่างต่อเนื่อง ซึ่งการรักษามักจะเป็นการนำกลับเข้าไปเพียงครั้งเดียว และเซลล์ที่ถูกสอนแล้วจะสามารถต่อสู้กับมะเร็งไปได้เรื่อยๆ เป็นต้น
ปัจจุบันมีผลิตภัณฑ์ยา ATMPs ที่ได้รับการอนุมัติจาก FDA หรือสำนักงานคณะกรรมการอาหารและยาแห่งสหรัฐอเมริกากว่า 45 ตัว มีทั้งยาที่ใช้เทคโนโลยี คาร์ทีเซลล์ สำหรับรักษาโรคมะเร็ง ยาที่รักษาโรคฮิโมฟีเลีย B รักษาโรคธาลัสซีเมียชนิดพึ่งพาการถ่ายเลือด โรคผิวหนังพันธุกรรมชนิดรุนแรง โรคกล้ามเนื้อสันหลังฝ่อ หรือจอประสาทตาเสื่อมจากพันธุกรรม
สำหรับภาพรวมของตลาด จากข้อมูลของ Pioneering Marketdigits บริษัทที่ปรึกษาด้านการตลาดดิจิทัล รายงานว่าในปี ค.ศ.2023 ตลาด ATMPs นั้นมีมูลค่าอยู่ที่ 25.5 พันล้านดอลลาร์สหรัฐ และคาดการณ์ว่าจะเติบโตสูงขึ้นเป็น 61.5 พันล้านดอลลาร์สหรัฐในปี ค.ศ. 2030 (โตกว่า 3 เท่า) โดยในปี ค.ศ. 2023 – 2030 ตลาด ATMPs จะมีอัตราการเติบโตเฉลี่ยต่อปี (Compound Annual Growth Rate – CAGR) อยู่ที่ร้อยละ 13.4
แล้ว ATMPs มันคือ ‘ยา’ ที่ ‘ว้าว’ ตรงไหน?
แม้เทคโนโลยีการแพทย์ของโลกจะก้าวหน้าขึ้นมากกว่าแต่ก่อน แต่ก็มีโรคที่หายากอย่างน้อย 7,000 ชนิดทั่วโลก และมีแนวโน้มจะถูกค้นพบใหม่ขึ้นเรื่อยๆ เพราะโลกนี้มีการค้นพบโรคใหม่แทบทุกปี รวมไปถึงเกิดการกลายพันธุ์ของยีนแบบใหม่ๆ ที่ยังไม่เคยพบมาก่อนซึ่งมนุษย์มีการกลายพันธุ์ต่อรุ่นอยู่ระหว่าง 98–206 ครั้ง ต่อการถ่ายทอดพันธุกรรม 1 ครั้ง และร้อยละ 95 ของโรคเหล่านี้ยังไม่มีวิธีรักษา
มูลนิธิเพื่อผู้ป่วยโรคหายาก ได้ให้ข้อมูลไว้ว่า ประเทศไทยน่าจะมีผู้ป่วยโรคหายากรวมหลายหมื่นคน ส่วนใหญ่ ร้อยละ 80 มีสาเหตุมาจากทางพันธุกรรม และร้อยละ 50 ของผู้ป่วยโรคหายากเป็นผู้ป่วยเด็ก ซึ่งโรคเหล่านี้ยังหาวิธีการรักษาได้อย่างยากลำบากจนถึงปัจจุบัน ส่วนใหญ่เกิดในระดับพันธุกรรม
สำหรับโรคที่มีความผิดปกติด้านพันธุกรรม แม้ว่าจะเคยมีการปรับปรุงยีนในมนุษย์ตั้งแต่ระยะตัวอ่อนของนักวิทยาศาสตร์จีนชื่อ ดร.He Jiankui แห่ง มหาวิทยาลัย Southern University of Science and Technology ในปี 2018 เขาได้ตัดแต่งยีนในระยะตัวอ่อนเพื่อให้เด็กต้านทางเชื้อ HIV ซึ่งได้รับถ่ายทอดมาจากพ่อแม่ แต่สุดท้ายแล้วก็ได้รับเสียงวิพากษ์วิจารณ์อย่างรุนแรงว่าละเมิดจริยธรรมการแพทย์ และการปรับยีนแบบถาวรนั้นอาจจะสืบทอดไปยังรุ่นถัดไปและเกิดความเสี่ยงในอนาคตที่ไม่สามารถควบคุมได้ รวมถึงเข้าถูกจับกุมในปี 2019 และจำคุก 3 ปี โดยจุดยืนของนานาชาติยังมองว่าการปรับแต่งยีนของตัวอ่อนยังไม่ควรทำ จนกว่าจะมีมาตรฐานและกฎหมายที่ชัดเจน
แต่ ATMPs เป็นการแก้ยีนในเซลล์ร่างกายของผู้ป่วยซึ่งสามารถทำได้เพราะให้ผลแก่ผู้ป่วยเท่านั้น ไม่ใช่การแก้ยีนในตัวอ่อนของเด็กซึ่งผลของมันสามารถส่งต่อไปยังรุ่นถัดไปได้ การรักษาด้วย ATMPs จึงเป็นหนึ่งในหนทางการรักษาโรคที่เกิดจากพันธุกรรม ที่กินปริมาณกว่า 80% ของโรคหายากนั่นเอง
โดยสรุปยา ATMPs ในปัจจุบันจึงมุ่งที่จะวิจัยและพัฒนาเพื่อรักษาโรคที่แต่เดิมไม่อาจสามารถทำได้ หรือทำได้แต่ประสิทธิภาพยังไม่ได้ดีมากนัก และนั่นคือเหตุผลที่ ATMPs เป็นสิ่งที่วงการวิทยาศาสตร์การแพทย์ทั่วโลกมะรุมมะตุ้มค้นคว้าและพัฒนากัน เพราะขอบเขตความเป็นไปได้ของมันนั้นกว้างใหญ่มหาศาล!
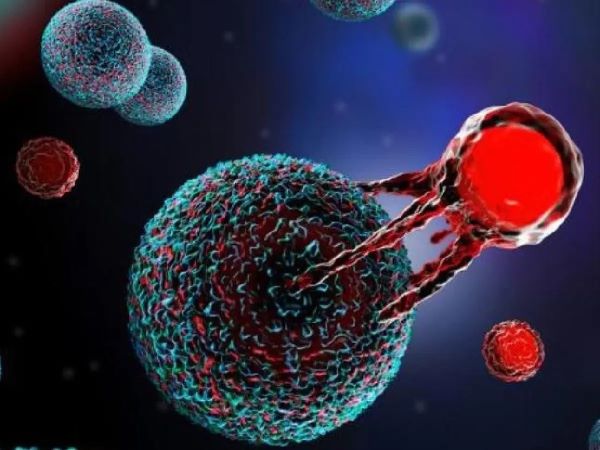
ATMPs ตัวแรกของโลก!
สำหรับ ATMPs ตัวแรกที่จดทะเบียนและได้รับการอนุมัติอย่างถูกต้องนั้นเกิดขึ้นในปี 2003 เป็นยาแบบยีนบำบัดตัวแรกของโลก ที่เกิดขึ้นในประเทศจีน ที่ได้รับการอนุมัติในเชิงพาณิชย์ ใช้สำหรับการรักษามะเร็งที่ศีระษะและลำคอซึ่งต้องใช้ร่วมกับการฉายแสง แต่ยาตัวนี้ไม่ได้รับการอนุมัติในสหรัฐและยุโรป
สำหรับในฝั่งตะวันตก ยุโรปถือเป็นภูมิภาคแรกที่ได้อนุมัติ ATMPs โดยอนุมัติในปี 2009 เป็นยารักษากระดูกอ่อนบริเวณข้อเข่าที่เสียหายจากอุบัติเหตุหรือการสึกหรอของข้อ แต่ในปี 2016 ก็ถูกถอนออกจากตลาดเนื่องจากต้นทุนการผลิตสูงและมีข้อจำกัดทางธุรกิจ
ต่อมาในวันที่ 30 สิงหาคม 2017 สหรัฐอเมริกาจึงอนุมัติยาตัวแรกที่ใช้เทคโนโลยี คาร์ทีเซลล์ รักษามะเร็งเม็ดเลือดขาวชนิด B-cell ที่ดื้อยาและกลับมาเป็นซ้ำ และเป็นการรักษาด้วย คาร์ทีเซลล์ ตัวแรกของโลก ซึ่งเป็นการพัฒนายาร่วมกับมหาวิทยาลัยเพนซิลวาเนีย
อย่างไรก็ตาม อ้างอิงจากราคายาในสหรัฐฯ ยากลุ่ม ATMPs มีราคาสูงมาก เนื่องจากเป็นการรักษาเฉพาะบุคคล คือ นำเซลล์ของบุคคลนั้นออกมาพัฒนาและนำกลับไปในร่างกาย และใช้เทคโนโลยีขั้นสูง สำหรับยาคาร์ทีเซลล์ ในสหรัฐอเมริกา ราคาจะอยู่ที่ราว 15 ล้านบาท ส่วนยาในกลุ่มยีนบำบัดที่รักษาโรคอื่นๆ นั้นอยู่ที่ราว 75 ล้านบาท ถึง 126 ล้านบาท ส่วนการรักษาในระดับเนื้อเยื่อจะมีราคาที่หลากหลายกว่าตั้งแต่ต่ำไปจนสูง
ATMPs ตัวแรกของไทยเมื่อไหร่?
ย้อนไป 2 ปี ในปี พ.ศ.2566 สำนักงานคณะกรรมการอาหารและยาของไทยเพิ่งประกาศให้ ATMPs เป็น ‘ยา’ นัยหนึ่งเพื่อผลักดันและสร้างขอบเขตของการพัฒนายา ATMPs ในไทยให้ชัดเจน เนื่องจากมีมหาวิทยาลัยและบริษัทหลายแห่งได้เริ่มมีการพัฒนา ATMPs ขึ้นแล้ว แต่ในมุมหนึ่งก็มีการแอบอ้างใช้ ATMPs บางประเภทในคลินิกทั่วไป ซึ่งหากไม่มีการควบคุมที่ถูกต้องถึงที่มาที่ไปของ ‘สิ่ง’ เหล่านั้น ย่อมจะส่งผลเสียและกระทบความปลอดภัยต่อประชาชน
อีกนัยหนึ่ง คือ เป็นการดึงเอาการรักษาด้วย ยีน เซลล์ และเนื้อเยื่อ ทุกชนิดให้มาอยู่ภายใต้กฎและขอบเขตการวิจัยและพัฒนา ‘ยา’ ซึ่งกรอบการดำเนินงานมีลำดับขั้นตอนชัดเจน
ผ่านมา 1 ปี ในช่วงปลายปี 2567 กระทรวงสาธารณสุขได้ออกตัวชัดเจนที่จะผลักดัน ATMPs นอกจากจะประกาศเป็นแผนการดำเนินงานตามยุทธศาสตร์ ‘เศรษฐกิจสุขภาพ’ เพื่อเสริมความแข็งแกร่งของการเป็น Medical Hub พูดง่ายๆ คือการหาเงินเข้าประเทศ โดยกำหนดให้ ATMPs เป็นหนึ่งในยุทธศาสตร์สำคัญ โดยมีเป้าหมายที่จะอนุมัติผลิตภัณฑ์ ATMPs จำนวน 2 รายการ ในปี 2568-2569
และล่าสุดทางรมว.กระทรวงสาธารณสุขยังประกาศว่าจะให้ สปสช. พิจารณาเพื่อนำเข้าสู่ระบบ ‘บัตรทอง’
แหล่งข้อมูล






